Els investigadors del laboratori Plasticitat Cel·lular en Desenvolupament i Malaltia, que dirigeix Ángela Nieto a l'Institut de Neurociències (IN), centre mixt de la Universitat Miguel Hernández d'Elx (UMH) i del Consell Superior d'Investigacions Científiques (CSIC), han descobert el mecanisme que permet a les cèl·lules mare del cervell adult expressar tant els gens de manteniment de la seua identitat com els de diferenciació neuronal sense que es produeixquen conflictes a l'activitat cel·lular. A més, este mecanisme permet que les cèl·lules mare estiguen preparades per diferenciar-se ràpidament.
Totes les cèl·lules d'un organisme tenen els mateixos gens, però la diferència entre les unes i les altres està en els gens que expressen i els que no. Això és el que es coneix com a identitat cel·lular i determinarà les funcions de les cèl·lules al llarg de la seua vida. El cas de les cèl·lules mare cerebrals és molt particular perquè expressen els gens que les mantenen com a cèl·lules mare, però també expressen altres gens que són propis de les neurones que produeixen.
Fins ara, es desconeixia com era possible que, a pesar de expressar ambdós tipus de gens, s'evités el que es coneix com un conflicte de decisió, és a dir, que la cèl·lula no entengui si s'ha de convertir en una neurona o si es ha de mantindre com una cèl·lula mare. Tot i això, els resultats d'este estudi, publicat recentment a la revista Nature Communications, han revelat el mecanisme que preveu que els gens de diferenciació es tradueixin en les cèl·lules mare, resolent així el suposat problema del conflicte de decisions en les activitats de les diferents. cèl·lules.
“Quan els gens es transcriuen, generen ARN missatgers que després es tradueixen en proteïnes, les efectores de les funcions cel·lulars. Perquè este procés es produeixi cal que estes missatgers ixcan del nucli de la cèl·lula i vagen al citoplasma per traduir-se correctament”, apunta Ainara González Iglesias, primera autora de l'article. Els experts van descobrir que la clau és que els ARN missatgers dels gens de les cèl·lules mare sortien del nucli per traduir-se a proteïnes, mentre que els missatgers dels gens neuronals es quedaven retinguts al nucli. "Per això les cèl·lules seguien mantenint la seua condició de cèl·lules mare", explica la investigadora.
Quan les cèl·lules mare s'han de diferenciar per donar lloc a neurones, el mecanisme funciona de la mateixa manera. Nieto explica que, en este cas, “són els missatgers dels gens de manteniment de cèl·lules mare els que es queden retinguts al nucli i, per tant, no es poden traduir a proteïnes i realitzar la seua funció”. Tot i que tots dos tipus de gens estiguen expressats en cada moment, “sempre es queden retinguts els missatgers dels quals no han de funcionar”, destaca la investigadora i posa èmfasi que: “Este mecanisme, no només ajuda les cèl·lules a no tindre un conflicte de decisió, sinó que, a més, permet tindre la maquinària preparada per poder diferenciar-se immediatament així que reben el senyal per fer-ho”.
Les cèl·lules mare tenen la capacitat de regenerar teixits i, a pesar de que en el cas del cervell humà no se sap del cert fins a quin punt contribueixen a la regeneració cerebral a l'adult, la investigadora assenyala que el funcionament correcte d'este mecanisme és fonamental, perquè en cas contrari podria produir-se una diferenciació neuronal prematura, que dificultaria el funcionament adequat del sistema nerviós.
Esta investigació s'ha realitzat amb la col·laboració del laboratori que dirigeix Isabel Fariñas, experta en cèl·lules mare, a l'Institut de Biotecnologia i Biomedicina de la Universitat de València i del laboratori que dirigeix Juan Valcárcel, expert en mecanismes de processament de l'ARN, al Centre de Regulació Genòmica de Barcelona. Per dur-la a terme, els investigadors han estudiat la zona subventrecular del cervell del ratolí adult, ja que és una regió que presenta una població molt àmplia de cèl·lules mare. Estudiant esta zona van poder comprovar que el mecanisme de retenció al nucli té a veure amb la falta d'una modificació de l'ARN que s'anomena metilació, que indueix l'eliminació dels introns, uns fragments de l'ARN missatger que cal eliminar perquè ixcan del nucli i es tradueixin les proteïnes.
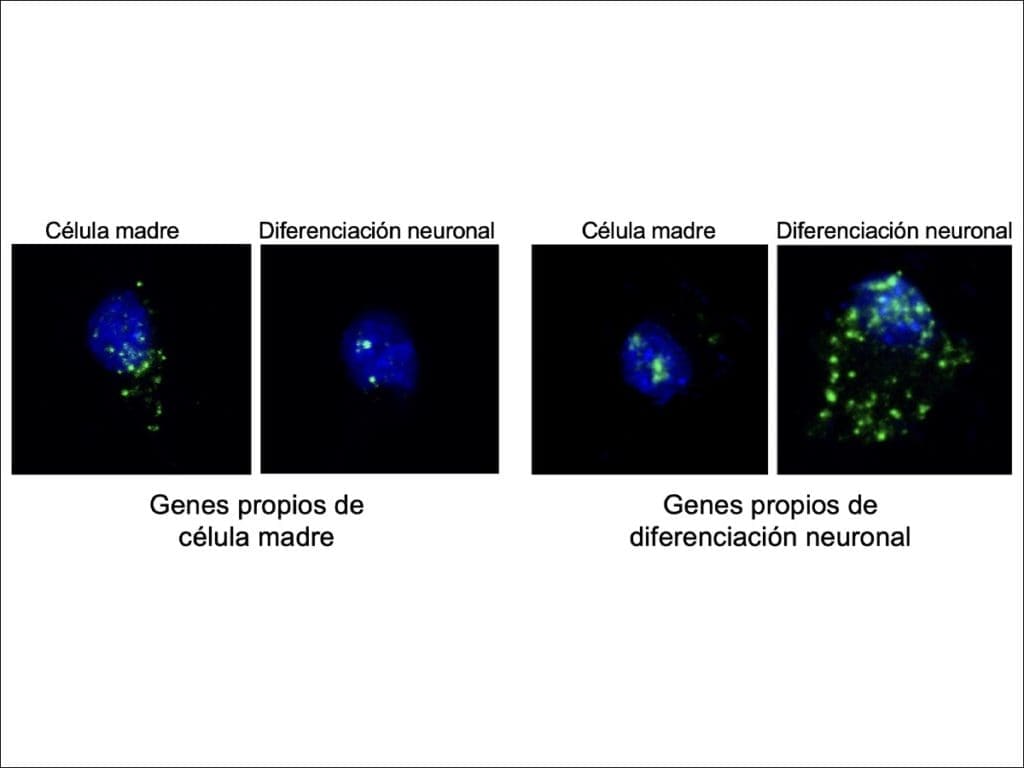
A través de la hibridació in situ, una tècnica que permet veure l'ARN missatger al teixit mitjançant l'ús de sondes marcades, els experts van ser capaços d'observar detalladament com l'ARN missatger quedava retingut al nucli. Va ser precisament l'ús d'esta tècnica, àmpliament utilitzada al laboratori que dirigeix Nieto a l'IN, cosa que va permetre als investigadors identificar el mecanisme complet: “Encara que ara hi ha tècniques de seqüenciació més modernes, si no haguéssim utilitzat la hibridació in situ, no haguéssim detectat el que estava succeint al nucli de les cèl·lules”, explica González-Iglesias.
Este treball ha estat possible gràcies al finançament del Ministeri de Ciència i Innovació, l'Institut de Salut Carles III, els Programes ISIC i PROMETEU de la Generalitat Valenciana, el Ministeri d'Educació, Cultura i Esports, el Programa Severo Ochoa per a Centres d'Excel·lència a Recerca i Desenvolupament de l'Agència Estatal de Recerca, el Consell Europeu de Recerca (ERC) i el Programa CERCA de la Generalitat de Catalunya.






